EL ÁTOMO
El ÁTOMO
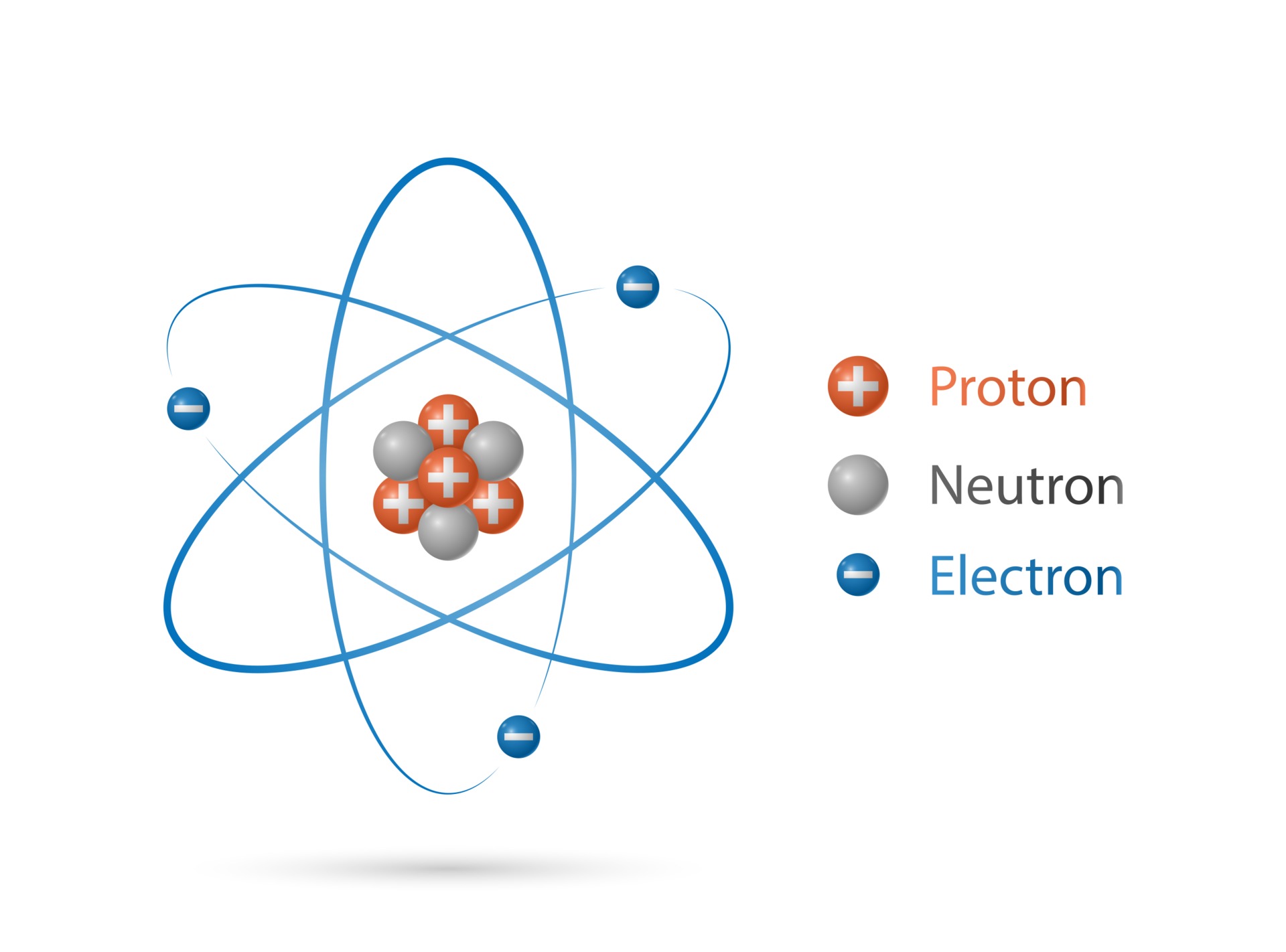
Todo ÁTOMO está formado por tres tipos de partículas más pequeñas, llamadas partículas subatómicas.
- Los PROTONES y los NEUTRONES se encuentran en la parte central del átomo denominada NÚCLEO ATÓMICO.
- Los ELECTRONES se encuentran girando a grandes velocidades alrededor del NUCLEO ATOMICO en los denominados NIVELES DE ENERGÍA.
- Los PROTONES son partículas nucleares con carga eléctrica positiva y que poseen una determinada masa.
- Los NEUTRONES son partículas nucleares que no tienen carga eléctrica (son neutros) y posee una masa igual a la de los protones.
- Los ELECTRONES son partículas que se ubican fuera del núcleo atómico (en los NIVELES ENERGÉTICOS), que poseen carga eléctrica negativa y cuya masa es casi 2000 veces menor a la de los protones, por lo tanto se la considera despreciable.
- Los NIVELES ENERGÉTICOS son zonas alrededor del NÚCLEO ATÓMICO en donde se encuentran girando los ELECTRONES. Un átomo puede llegar a tener 7 niveles energéticos como máximo y los mismos se enumeran del 1 al 7 comenzando por el nivel más cercano al núcleo.
¿Cómo de determinan la cantidad de protones, neutrones y electrones que tienen los distintos átomos?
Para poder saber la cantidad de partículas subatómicas que forman a un determinado ÁTOMO, es necesario conocer dos datos muy importantes sobre ese ÁTOMO.
Esos dos datos, que se extraen de la TABLA PERIODICA, son dos números que identifican a cada ÁTOMO (algo así como sus números de documento y cédula) y que se llaman:
• NÚMERO ATÓMICO
• NÚMERO MÁSICO
¿QUE REPRESENTA CADA UNO DE ÉSTOS NUMEROS?
El NÚMERO ATÓMICO (Z) representa la cantidad de PROTONES que tiene un átomo en su NUCLEO.
El NÚMERO MÁSICO (A) representa la cantidad de partículas totales que hay en el NUCLEO ATOMICO, es decir es la suma de los PROTONES y los NEUTRONES.
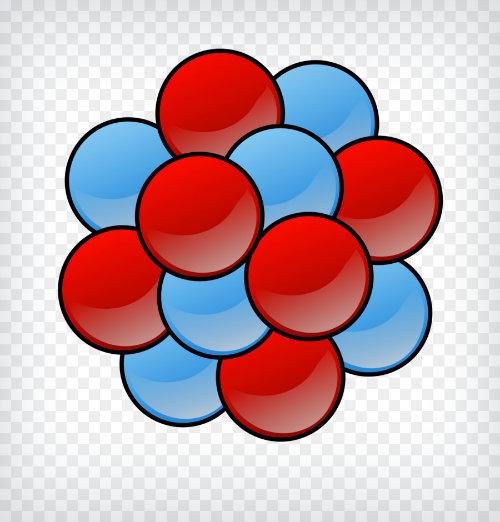
El núcleo del átomo de carbono tendrá entonces 6 protones y 6 neutrones.NÚCLEO DEL ÁTOMO DE CARBONO
ATENCIÓN!!!👀
En todo ATOMO la cantidad de PROTONES y de ELECTRONES es igual, debido a que el ATOMO es neutro, por lo tanto la cantidad de carga eléctrica positiva debe ser igual a la cantidad de carga eléctrica negativa.
RESUMIENDO
NÚMERO ATÓMICO = CANTIDAD DE PROTONES = CANTIDAD DE ELECTRONES
NÚMERO MASICO = CANTIDAD DE PROTONES + CANTIDAD DE NEUTRONES
CANTIDAD DE NEUTRONES = NÚMERO MÁSICO - NÚMERO ATÓMICO
RESPONDER
1) ¿Cuáles son las partículas subatómicas?
2) ¿Qué carga eléctrica tienen las partículas que están en el núcleo del átomo?
3) ¿Cómo se llaman las partículas que se encuentran moviéndose alrededor del núcleo en distintos niveles de energía llamados orbitales atómicos? ¿Qué carga eléctrica tienen?
4) ¿Cuantos orbitales hay? ¿Cuántos electrones entran en cada orbital?
5) ¿Qué es el número atómico? ¿Con qué letra se simboliza?
6) ¿Qué es el número másico o masa atomica?¿Con qué letra se simboliza?
7) ¿Qué cuenta se debe hacer para averiguar la cántidad de neutrones que tiene un átomo?
8) ¿Cuál es el número atómico de un elemento cuyos átomos tienen 54 protones en su núcleo?
9) Si un elemento tiene 20 cómo número atómico ¿Cuántos protones tiene en su núcleo?
10) ¿ Cuál es la masa atómica o número másico de un elemento cuyos átomos tienen 11 protones y 12 neutrones en su núcleo? Justifica tu respuesta
11) ¿ Cuántos electrones tienen los átomos de un elemento, si en su núcleo tiene 16 protones?
12) SIN MIRAR LA TABLA y utilizando solamente los datos que ofrece el siguiente diagrama del átomo del elemento aluminio. Responde:
a) ¿Si el átomo es neutro, cuántos protones deberá tener el aluminio?
b) ¿Cuál es el número atómico del aluminio?
c) ¿Puedo saber su masa con sólo ver el dibujo? Explica tu respuesta.
d) Ahora si, busca en la tabla periódica e indica cuál es el número másico.
e) ¿Cuántos neutrones tiene el átomo de aluminio?
f) Si tuvieras que dibujar los protones y neutrones que tiene el aluminio ¿Dónde lo harías?
g) Justifica por qué el aluminio se encuentra en el período 3 grupo 13 o III A.





Comentarios
Publicar un comentario